Aurora A是Aurora丝/苏氨酸激酶家族成员,在中心体成熟,纺锤体装配和染色体分离中扮演着重要的角色。Aurora A的表达和活性在细胞内被严格的调控,一旦失调,将会导致基因组不稳定、非整倍性和肿瘤形成。Aurora A在大多数肿瘤中异常高表达,与患者不良预后及更短的生存期相关,其高表达导致肿瘤细胞恶性增殖、上皮间质转化、转移、肿瘤干细胞的自我更新等。因此,Aurora A是一直以来作为重要的肿瘤治疗靶标受到各大制药公司的青睐。尽管许多Aurora A抑制剂在临床前研究中展现出良好的抗肿瘤效果,然而,在大部分肿瘤临床试验中,这些抑制剂并没有达到预期的治疗效果。目前,唯一一个进入临床三期试验的Aurora A抑制剂——Alisertib,由于在复发或难治性外周T细胞淋巴瘤的临床试验中药效不显著而被终止。Aurora A抑制剂临床抗肿瘤疗效不显著的原因目前还不清楚。
亿百体育入口(集团)官方网站新靶标与化学干预研究中心党永军团队联合中国科学院上海药物研究所罗成团队在The Journal of Clinical Investigation上发表了题为“Aurora A kinase inhibition elevates PD-L1 expression and compromises its anti-tumor efficacy”的研究论文。在该项工作中,研究人员发现Aurora A抑制剂Alisertib可增加肿瘤细胞及小鼠体内免疫细胞中免疫检查点蛋白PD-L1的表达、抑制小鼠的T细胞抗肿瘤免疫反应、促进肿瘤免疫逃逸和耐药。这可能是Alisertib抗肿瘤药效丧失的主要原因,PD-L1阻断治疗则可以显著改善Alisertib的抗肿瘤效果。

党永军团队针对肿瘤免疫建立了一系列高通量筛选技术,以发现调控肿瘤微环境的活性小分子,并深入展开机制研究。发现L-5HTP可特异抑制干扰素-γ诱导的PD-L1表达,并激活T细胞抗肿瘤免疫反应而发挥抗肿瘤效应(Journal for ImmunoTherapy of Cancer,2022);铂类化合物Bis(benzonitrile) dichloroplatinum (II)可以破坏PD-1/PD-L1的相互作用,增强肿瘤微环境中T细胞杀伤活性来抗肿瘤(Acta Pharmacologica Sinica,2023);并且,还利用建立的尿液来源膀胱癌原代细胞来评价PD-L1的表达、对干扰素-γ的响应等,从而预测患者对免疫治疗的效果,这能作为一种快速且无创的方法来指导临床治疗(Genes & Diseases,2022)。
本项研究中研究人员利用高通量流式筛选发现Aurora A抑制剂Alisertib可以提高肿瘤细胞膜表面PD-L1的表达,AURKA基因敲减后PD-L1也会出现明显的上调。研究人员同时在免疫完整小鼠和免疫缺陷的裸鼠中移植肿瘤细胞并用Alisertib进行处理。结果表明,Alisertib可以显著抑制裸鼠中肿瘤的生长,而在免疫完整小鼠中Alisertib的抗肿瘤作用几乎丧失,提示免疫调控与Alisertib的抗肿瘤效果密切相关。这是否由于Alisertib提高PD-L1表达导致免疫逃逸所致?研究人员利用PD-L1敲除肿瘤细胞和PD-L1敲除小鼠模型,发现当肿瘤细胞或小鼠体内缺失PD-L1时,Alisertib的抗肿瘤效果明显提高(图一)。表明Alisertib诱导PD-L1上调是导致其抗肿瘤药效丧失、肿瘤耐药的主要原因。同时,研究人员提出Alisertib与PD-L1抗体联用的协同抗肿瘤策略,成功解决了因PD-L1上调导致的Alisertib耐药问题(图二)。

(图一:Aurora A抑制剂在小鼠体内上调PD-L1表达并抑制其自身抗肿瘤药效。A.Alisertib在WT小鼠和裸鼠中的抗肿瘤药效. B-C.Alisertib可以提高WT小鼠和裸鼠中PD-L1的表达. D.Alisertib在荷WT肿瘤细胞系和PD-L1缺失肿瘤细胞系模型中的抗肿瘤药效. E.Alisertib在WT小鼠和PD-L1缺失的荷瘤小鼠中的抗肿瘤药效.)
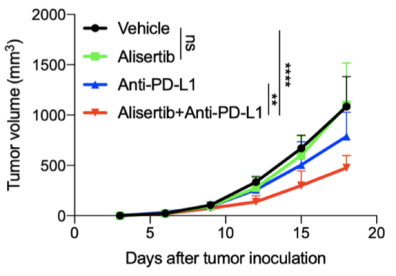
(图二:PD-L1阻断治疗可以改善Alisertib的抗肿瘤药效.)
进一步的机制研究表明,Aurora A激酶活性被抑制后可通过降低cGAS磷酸化水平提高cGAS的活性,进而激活下游的STING-NF-κB通路以促进PD-L1的转录上调。同时,研究人员通过对肿瘤组织芯片的免疫组化染色,发现临床肿瘤患者的肿瘤组织中Aurora A活性和PD-L1表达之间呈明显的负相关。
综上所述,该研究揭示了Aurora A抑制剂的免疫调节功能及导致其在临床试验中抗肿瘤药效不佳的潜在原因,对于改善该类抑制剂临床抗肿瘤效果具有重要的意义。
亿百体育入口(集团)官方网站新靶标与化学干预研究中心党永军教授、中科院上海药物所罗成课题组张元元副研究员、复旦大学基础医学院代谢分子医学教育部重点实验室李增霞副教授和蒋维研究员为该论文的共同通讯作者,复旦大学基础医学院代谢分子医学教育部重点实验室王晓博博士、中科院上海药物所黄靖博士和复旦大学附属中山医院刘凤林主任医师为本文的共同第一作者。