代谢紊乱相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)是一类受基因和环境等多种因素影响的代谢性肝脏疾病,其进一步发展为肝硬化、肝癌的风险显著增加,并能促进动脉硬化性心脑血管疾病、慢性肾病和肿瘤的发生。胰岛素抵抗、内质网应激、肠道菌群紊乱以及遗传因素等均可能参与MAFLD的进展,但其发病机制尚未完全阐明。
2023年3月14日,我校感染性疾病分子生物学教育部重点实验室黄爱龙/唐霓教授课题组在Nature Communications杂志在线发表了题为“Deficiency of gluconeogenic enzyme PCK1 promotes metabolic-associated fatty liver disease (MAFLD) through PI3K/AKT/PDGF axis activation in male mice”的最新研究成果。该研究首次发现糖异生关键酶磷酸烯醇式丙酮酸羧激酶1(phosphoenolpyruvatecarboxy kinase 1, PCK1)的缺失导致肝细胞内脂质沉积,通过活化RhoA/PI3K/AKT/PDGF-AA信号轴激活星状细胞,促进肝脏纤维化的发生。靶向RhoA/AKT信号通路等干预策略,将为MAFLD提供新的治疗策略和靶点。

研究团队首先分析GEO数据库资料,发现MAFLD患者肝组织中糖异生关键酶PCK1的表达显著下调。通过体外棕榈酸(palmitic acid,PA)处理模拟MAFLD代谢环境,确认PA上调负性转录调控因子ATF3,抑制PCK1基因的转录,揭示了脂代谢紊乱环境下PCK1低表达的新机制。为研究PCK1在MAFLD进展中的潜在作用,研究团队通过建立高脂饲料联合高果糖/葡萄糖饮水喂养饮食模型,发现肝细胞特异性敲除Pck1可促进肝脏炎症反应与纤维化病变。在cPtenf/fPck1f/f敲除小鼠模型中发现cPtenf/fPck1f/f小鼠的肝损伤和脂代谢紊乱相较于cPtenf/f小鼠更严重,提示在Pten缺失的遗传学动物模型中,Pck1缺失进一步加重肝脏脂肪变性、炎症和纤维化。而采用腺相关病毒AAV-Pck1回复PCK1的表达可延缓MAFLD进展,证实了PCK1在MAFLD进展中具有重要的保护作用。
为揭示肝细胞PCK1缺失促进MAFLD进展的分子机制,研究人员通过转录组测序、靶标和非靶标代谢组学检测,发现肝细胞PCK1缺失可促进脂肪酸运输和脂滴形成相关基因如CD36、CIDEC等表达上调,甘油三酯合成底物3-磷酸甘油醛累积。通过原代肝细胞和星状细胞共培养实验,研究人员发现PCK1缺失可通过激活RhoA/PI3K/AKT信号通路,增加肝细胞中血小板衍生生长因子AA(platelet-derived growth factor AA,PDGF-AA)的分泌,并促进共培养的肝星状细胞活化。而采用慢病毒载体介导的基因方法或抑制剂干预AKT和RhoA,可延缓肝特异敲除PCK1小鼠的MAFLD进展。
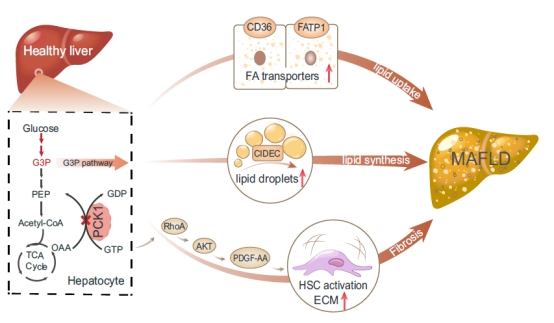
PCK1调控代谢紊乱相关脂肪性肝病进展的机制图
上述研究发现PCK1缺乏可导致肝细胞内脂质沉积,并通过激活RhoA/PI3K/AKT/PDGF-AA信号轴,促进肝纤维化和MAFLD进展。以上结果揭示了糖异生关键酶PCK1通过对糖脂代谢的调控,以“肝细胞-星状细胞交互对话”的方式,调控MAFLD进展的分子机制。干预PCK1下游靶基因及信号通路可能为MAFLD治疗提供新靶点和新思路。
亿百体育入口(集团)官方网站博士生叶倩、刘异、张桂冀、副研究员邓海君,陆军军医大学西南医院王小军以及四川省人民医院庹琳为该论文的共同第一作者,亿百体育入口(集团)官方网站黄爱龙教授、唐霓教授、汪凯副研究员为该论文共同通讯作者。该工作获得了国家自然科学基金区域联合重点项目、重庆英才计划、重庆市科卫联合医学科研重大项目和重庆市中青年医学卓越团队等项目支持。